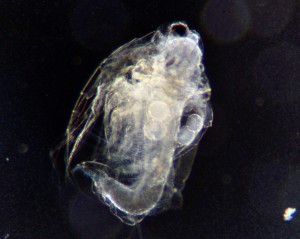
写真は1970年代にバルサム封入で作った永久プレパラート。本来ならとっくに土に還っているはずの有機物が保存されていることに驚きと感動を覚える。気泡が入っているものがある。当時の市販品(プリンス光学製)はほぼ全滅。気泡が入ると永久プレパラートが台無し。この謎を解明する。
今回、ミジンコの永久プレパラートに挑戦する。大型の動物プランクトン。固定や染色、脱水に時間がかかるうえ、形が崩れやすい。気泡のない品質のプレパラートを完成するのが目標だ。
気泡の原因
作ったばかりのとき気泡が見えなくても、時間が経つと気泡が出てしまうことがある。
1970年代、当時小学生だった私はアルコール脱水後のキシロール置換を省略した為と考えた(当時のビクセンのプレパラート作成手順には、最後にキシロール置換せよとあったが、キシロールそのものが入手できなかった)。
プレパラートが気泡で台無しになるのは、脱水不良が原因ではないだろうか。
 写真はキシロール(キシレン)、ホルマリン、硫酸銅。薬局で取り寄せ。
写真はキシロール(キシレン)、ホルマリン、硫酸銅。薬局で取り寄せ。
これらの扱いは保護メガネ、手袋、マスク、排気装置などが必要。廃液の適切な処理も必要になる。
永久プレパラートはこのような危険な薬品を使わないと出来ないところが課題。素人が趣味で手を出せるものではない(ちなみに私は毒劇物の取扱資格を持っています)。
酢と水飴で試してみる
そう思って文献1 を参考に酢と水飴だけで作ってみた。結果は写真のように失敗。酢で手足がバラバラになり、水飴で収縮し無残な姿に。
予備実験の結果、ミジンコに対し糖類、酢酸、グリセリンは使えないことが判明。薄い濃度から始めても時間が延びるだけで結果は同じだった。
ミジンコの永久プレパラートは、難しい対象の一つといえる。
ミジンコをプレパラートにする工程
何度も失敗を繰り返した末に得た、ミジンコのプレパラート製作工程は次の通り。
1.固定
2.脱水1
染色液のアルコール濃度の手前まで脱水
3.染色
4.脱水2
水切りして脱水の続きを再開。最後は無水アルコール→完全無水とする。
5.キシレン置換
アルコールをキシレンに置き換える。
6.封入
以下順に詳しく説明する。
1.固定
水生生物の固定はホルマリン液のほか、Davidson液やシューガホルマリン液も使われるが、ミジンコは10%~20%ホルマリン液がベストだった。
ホルマリン液のレシピは次の通り。
・10%~20%ホルマリン液[2][3]
ホルムアルデヒドの濃度でないことに注意。局方ホルマリンを10倍または5倍に希釈したもので代用できる。ミジンコをアルコールに入れると手足が縮んでしまうが、ホルマリンで瞬殺すると手を開いた状態の標本が得られる。
ホルマリンは1時間あたり1mm浸透するので浸漬は2時間まで。8時間あたりから損壊が始まり時間と共に形が崩れていくので長時間の浸漬はできない。
他のレシピ(参考)
・Davidson液[4][5]
無水エタノール : 局方ホルマリン(37%ホルムアルデヒド) : 氷酢酸 : 水=33 : 22 : 12 : 33 (容積比)
Davidson液の成分はホルムアルデヒド8%、エタノール33%、氷酢酸11.5%。ここから混合比を求めると上記のように切りの良い整数比になる。少量の場合は重量で計量した方が作りやすい。この場合の混合比は 42 : 20 : 11 : 33 になる。
ミジンコに対しては上記ホルマリン液の方が形崩れしにくい。
・シューガホルマリン液
ホルマリン(4~10%)液 + ショ糖(4%~飽和)
シューガホルマリン液のレシピは文献によりマチマチ[6][7][8]。ショ糖(≒グラニュー糖)は常温で65wt%くらいまで溶けるので、10%ホルマリン液(4%ホルムアルデヒド)100mlに100g溶かして50wt%とするとよさそう。
水飴同様、この液もミジンコの収縮が起こる。糖類はミジンコの封入に使えない。
2.脱水1(~95%)
試料の水分をアルコールで置き換える。脱水工程ではアルコール濃度を徐々に濃くしていくが文献10 のように濃度の違う溶液をいくつも作り置きして移し替える従来法[11]と、以前考案した1/2換水法が[12]がある。1/2換水法は次の手順になる。
1.水に無水アルコール入れて50vol%溶液を作り所定時間浸漬する
2.1/2を捨てて、無水アルコールを元の量まで入れ所定時間浸漬する(これを4回繰り返す)
3.最後に無水アルコールに浸漬し、完全無水アルコールで仕上げる(工程4)。
この方法で換水した時のアルコールの濃度変化は下グラフの形になる。参考に、従来法(50%→70%→80%→85%→90%→95%)も記載した。ちなみに、1/2換水を40%換水(最後だけ50%)にすると濃度曲線が従来法と一致する。
写真は1/2換水法で脱水している様子。100均の製氷皿を利用し3ml捨てて3ml無水アルコールを追加していく。分量は厳密でなくてもいい。空いている場所に水を3ml、6mlを入れておいて水面の目安にするとやりやすい。
換水の比率を上げると回数が少なくて済む。ミジンコでは2/3換水2回(66% 1分→89%5分→酸性フクシン)としたのち、無水アルコールに移行して問題なかった。
3.染色
酸性フクシンのアルコール水溶液を脱水工程の中で使う。酸性フクシンのアルコール水溶液はクリエイティブ九州から通販で入手できる。これは95%アルコール溶液なので95%脱水後に使う。
染色がうまくいっても紫外線で退色、脱色してしまう(酸性フクシンで染色した標本を窓際放置したところ、1年くらいで完全に脱色してしまった)。染色液も、プレパラートも、冷暗所に保管することが大切。
他の方法(参考)
染色液はビクセンのセットが市販されている。一通り試した結果、ミジンコはサフラニンO、アセトカーミン、メチレンブルー、エオシン、ニュートラルレッドなどで色づくが、脱水工程でほぼ完全に脱色されてしまう。ビクセンの染色液は生きた標本の観察用であって、永久プレパラートの作成には向かない。
4.脱水2(95%→100%)
完全無水アルコールに移して脱水を行う。完全無水アルコールの作り方は後述。
ミジンコのハンドリングはスポイトなので、試料を移送するとき元の溶液が混じる。この際、元の溶液ができるだけ混じらないようため水切りする。
水切りは下の写真のように茶漉しを使う。スポイトでミジンコを乗せて水切りし、ひっくり返して新しい溶液をかけて落とす。アルコール蒸発による結露を防ぐために手早く作業する。
5.キシレン置換
水切り→キシレン1分→水切り→キシレン1分とする。
これでプレパラート不良の原因になる水分をほぼ完全排除できる。前工程で脱水不十分だとキシレンを入れたとき白濁するので、この時点で無水をチェックできる。
水分は結露によって混入する場合もある。特にアルコールを少量にすると急激に乾燥して冷えるため結露が起きやすい。
完全に脱水した試料をプレパラートに乗せてキシレンを垂らすと白濁して失敗、これはアルコールの揮発でガラス面が冷え、結露した水が混じった結果。
製作中に白濁したり、封入後に気泡で不良になる原因はこの結露とみられる。揮発の遅い溶媒に置き換える意味でも、アルコールのキシロール置換は重要といえる。
6.封入
スライドガラスに直接試料とキシレンを乗せると乾燥して結露しやすい。そこで、あらかじめ少量の封入剤を入れた瓶を用意しておき、キシレンごと吸い取った試料をスポイトで落とす。
瓶を揺するようにして攪拌したのち、そのまま静置してキシレンを蒸発させる。ある程度ねばりが出てきたら試料をスポイトで吸い取りスライドガラスに置く。
瓶は上でご紹介した茶漉の写真に写っている底丸のガラス瓶が使いやすい。
封入剤はカナダバルサムのほか、オイキット(EUKITT) が使える。ミジンコのように厚いものはオイキットがお勧め。カナダバルサムは乾燥が遅く、指蝕乾燥に数日、内部まで完全に固まるのに1年以上かかる。
ミジンコは厚みがあるので、封入液を多目に滴下してカバーガラスをかける。封入後、カバーガラスをずらしたり、外してかけなおすと試料が傷む。カバーガラスを置いたら気になることがあってもいじらないこと。
オイキット(EUKITT) の中身はポリメタクリ系の樹脂ガラスをキシレンで2倍程度に薄めたもの。キシレンが飛べば乾燥完了なのでバルサムより速く固まりヒケも少ない。
オイキットの硬化物はバルサムより堅牢で溶剤に溶けにくい。アルコールには溶けないので注意。
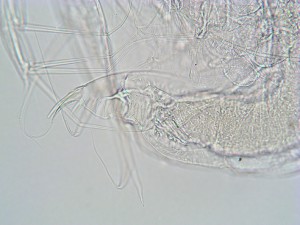
ミジンコを封入すると透明になってしまうので、染色しないと構造がよく見えない。写真はビクセンの染色液を使って染色した失敗作だが、みてくれはこのあたりが限界。
ミジンコは生きているものを観察するのが一番である。
他の方法(参考)
ミジンコはグリセリンに触れると形が崩れるため使えないが、昆虫など小動物や菌類の封入にグリセリンゼリーを使う場合もあるようだ[1]。これもいろいろ試してうまくいく工程を見つけたのでご紹介する。グリセリンゼリーの作り方は後述。
1.固定
2.染色
3.50wt%グリセリン浸漬
4.封入
加熱軟化させてた封入液に試料を浸漬→スポイトで吸い取ってスラドガラスに移す
4の工程で試料内部が完全に封入液に置き換わるのがベスト。
封入の際は加熱軟化させてからスライドガラスに移す。スライドガラスの上に乗せてから加熱軟化させると気泡が入ったり、試料がズレたりして失敗しやすい。
<関連商品>
オイキット バルサムの代替に使える封入剤
プレパラート 完成品や製作キットなど沢山の商品があります
プレパラート保存ケース 光を通さない木製のものがいいです
<計算ワークシート>
noudocal アルコール脱水や複数の薬剤を混合するときの濃度計算に便利なワークシートです
<関連記事>
12.新しい魚の水合わせ 1/2換水法の元になった記事です
オリンパスTG-4でタマミジンコを顕微鏡コリメート撮影する 生きているミジンコを撮影する方法です
遠心分離機の選び方~怪しい中華製品を買ってみた
中古顕微鏡の選び方
参考1.完全無水アルコールの作り方
完全脱水するため完全無水アルコールを作ってみた。脱水工程の最後に使う。このレシピは文献9,11 を参考にした。
まず硫酸銅の無水物を作り、無水硫酸銅に無水アルコールの水分を吸わせて完全無水アルコールを得る。
写真は硫酸銅をオーブントースターで加熱して無水物を作っている様子。温度設定を250℃にして放っておいたら表面が焦げてしまった。出来上がりも少し青っぽい。ネットで調べなおすと150℃くらいが適当だったらしい。いずれにせよ、よく攪拌しながら過熱する必要がある。
参考2.グリセリンゼリーの作り方
ゼリーの基材はゼラチンを使う。ゼラチン腐敗防止のためフェノールやホルマリンが使われるが、ヨードチンキやうがい薬、砂糖などで代用する例もあるらしい[1]。
Kaiser法を参考にした創造の館版のレシピは次の通り。
(1)粉状ゼラチン7gを 水42mlで膨潤(2hr)
(2)グリセリン 50gと防腐剤を投入
(3)電子レンジなどで沸騰しないよう加熱し混合
防腐剤はKaiser法だとフェノール0.55wt%。この代替候補は、10%ホルマリン(4%ホルムアルデヒド溶液)、イソジンうがい薬(ポビドンヨード7wt%水溶液)、ヨードチンキ(ヨウ素3wt%水溶液)、ショ糖など。
上記レシピと全体量を変えないで所定濃度が得られる投入量は次のようになる。イソジンとヨードチンキは色付くので少な目(0.1%)とした。
10%ホルマリン12.5g、水30ml (0.55wt%)
イソジン 1.4ml、水41ml (0.1wt%)
ヨードチンキ 3.3ml、水39ml (0.1wt%)
ショ糖 42g、水42ml (ショ糖は事前に水に溶かしておく)
外周をカナダバルサムやパラフィンバルサム[1]などで封じれば永久プレパラートにもなるようだが果たしてどうか。ゼラチンの代わりに寒天を使う事例がみられるが透明度が悪く検鏡に適さない。
<参考文献>
1.プレパラートの作製(封入剤等の情報)
2.病理組織学的検査 ~適切な固定とは~(リンク切れ)
3.(株)共同病理 各種固定法
4.成長に伴うオニテナガエビ造雄腺の組織像の変化 2010年度神奈川大学総合理学研究所共同研究助成論文(リンク切れ)
5.ホルマリンだけでは固定されない 中央水研ニュースNo.25(平成12年12月)
6.動植物プランクトン調査編 河川環境データベース(リンク切れ)
7.III.生物 霞ヶ浦データベース 測定方法
8.モニタリングサイト1000 陸水域調査 湖沼調査マニュアル
9.たのしいコナラジラミの試料づくり
10.固定・包理の基礎のノウハウ
11.構造細胞生物学のための電子顕微鏡技術 1. 基礎技術としての超薄切片法(リンク切れ)